Los seres humanos
siempre hemos estado tentados a encontrar una explicación a la complejidad de
la materia que nos rodea. Al principio se pensaba que los elementos de toda
materia se resumían al agua, tierra, fuego y aire. Sin embargo al cabo del
tiempo y gracias a la mejora de las técnicas de experimentación física y
química, nos dimos cuenta de que la materia es en realidad más compleja de lo
que parece. Los químicos del siglo XIX encontraron entonces la necesidad de ordenar
los nuevos elementos descubiertos. La primera manera, la más natural, fue la
de clasificarlos por masas
atómicas, pero esta
clasificación no reflejaba las diferencias y similitudes entre los elementos.
Muchas más clasificaciones fueron adoptadas antes de llegar a la tabla periódica que es utilizada en nuestros
días.
viernes, 4 de julio de 2014
CRONOLOGÍA DE LA CLASIFICACIÓN DE LOS ELEMENTOS QUÍMICOS
- Döbereiner
- Chancourtois y Newlands
- Meyer
- Mendeléiev
Esta tabla fue
diseñada de manera que hiciera aparecer la periodicidad de los elementos. De
esta manera los elementos son clasificados verticalmente. Las agrupaciones
horizontales se suceden representando los elementos de la misma “familia”.
Para poder aplicar
la ley que él creía cierta, tuvo que dejar ciertos huecos vacíos. Él estaba
convencido de que un día esos lugares vacíos que correspondían a las masas
atómicas 45, 68, 70 y 180, no lo estarían más, y los descubrimientos futuros
confirmaron esta convinción. El consiguió además prever las propiedades químicas
de tres de los elementos que faltaban a partir de las propiedades de los cuatro
elementos vecinos. Entre 1875 y 1886, estos tres elementos: galio, escandio y
germanio, fueron descubiertos y ellos poseían las propiedades predecidas.
Sin embargo aunque
la la clasificación de Mendeleïev marca un claro progreso, contiene ciertas
anomalías debidas a errores de determinación de masa atómica de la época.
Tabla periódica moderna
Un grupo de la tabla periódica es una columna vertical de la tabla. Hay 18 grupos en la tabla estándar. El hecho de que la mayoría de estos grupops correspondan directamente a una serie químmica no es fruto del azar. La tabla ha sido inventada para organizar las series químicas conocidas dentro de un esquema coherente. La distribución de los elementos en la tabla periódica proviene del hecho de que los elementos de un mismo grupo poseen la misma configuración electrónica en su capa más externa. Como el comportamiento químico está principalmente dictado por las interacciones de estos electrones de la última capa, de aquí el hecho de que los elementos de un mismo grupo tengan similares propiedades físicas y químicas.
VENTAJAS DE LA CLASIFICACIÓN DE LA TABLA PERIÓDICA
1.-Clasifica
los elementos en orden creciente a su peso atómico
2.-
Análisis de las propiedades periódicas de los elementos, es decir, la
comparación de sus propiedades según su ubicación en la tabla periódica.
3.-Establece familias y sub familias que tienen
propiedades semejantes, ejemplo la familia de los halógenos, alógenos
nitrogenoides del alcalino etc.
4.-Permite
conocer el número de niveles cuánticos que lleva un átomo.
5.-Permite
conocer el número de electrones que lleva un átomo en su último nivel cuántico.
6.-Permite
conocer el valor de electronegatividad de un elemento y predecir su reacción
7.-Permite
conocer la valencia negativa y positiva que tiene un elemento.
8.-Distribiye
adecuadamente en la tabla a los elementos; metálicos; no metalicos,gases
nobles; tierras raras
9.-Permite
desarrollar fácilmente la estructura de un átomo ya que de acuerdo al grupo y al
periodo, se deduce el número de electrones protones y neutrones.
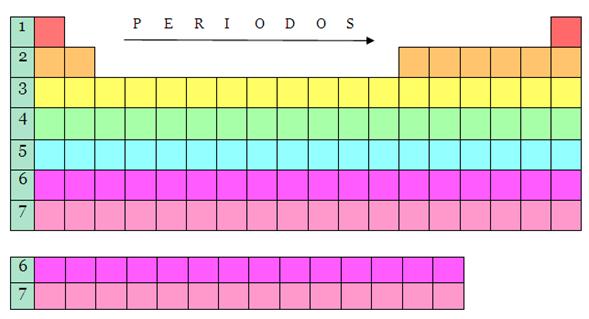
PERIODOS
Las filas horizontales de la tabla periódica son llamadas períodos. El
número de niveles energéticos de un átomo determina el periodo al que pertenece.
Cada nivel está dividido en distintos subniveles, que conforme aumenta su número atómico se van llenando en este orden:
Siguiendo esa norma, cada elemento se coloca según su configuración electrónica y da forma a la tabla periódica. Los electrones situados en niveles más externos determinan en gran medida
las propiedades químicas, por lo que éstas tienden a ser similares dentro de un mismo grupo, sin
embargo la masa atómica varía considerablemente incluso entre elementos adyacentes. Al
contrario, dos elementos adyacentes de mismo periodo tienen una masa similar,
pero propiedades químicas diferentes.
La tabla periódica consta de 7 períodos:
·
Periodo 1._ El primer período solo llena el
primer nivel de energía (1s) y contiene menos elementos que cualquier otra fila
de la tabla, sólo dos: el hidrógeno y el helio. Estos elementos se agrupan en
la primera fila en virtud de propiedades que comparten entre sí.
·
Periodo 2._ Se comienza una hilera nueva
cuando el comportamiento químico vuelve a repetirse, lo que significa que los
elementos de comportamiento similar se encuentran en las mismas columnas
verticales. El segundo período contiene más elementos que la hilera anterior,
con ocho elementos: Litio, Berilio, Boro, Carbono, Nitrógeno, Oxígeno, Flúor y
Neón.
·
Periodo 3._ El tercer periodo es aquello que
se haya compuesto por los siguientes elementos: Na, Mg, Al, Si, P, S, Cl, Ar.
·
Periodo 4._ El cuarto periodo se haya estructurados por los siguientes
elementos: K, Ca, Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Ga, Ge, As, Se, Br,
Kr.
·
Periodo 5._ El quinto periodo se haya
compuesto por estos elementos: Rb, Sr, Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd,
In, Sn, Sb, Te, I, Xe.
·
Periodo 6._ este periodo cuenta con los
siguientes elementos: Cs , Ba, Hf, Ta, W,
Re, Os, Ir, Pt, Au, Hg, Tl, Pb, Bi, Po, At, Rn,
La, Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, L
Periodo 7._ Son: Fr, Ra, Rf, Db, Sg,
Bh, Hs, Mt, Ds, Rg, Fl
GRUPOS
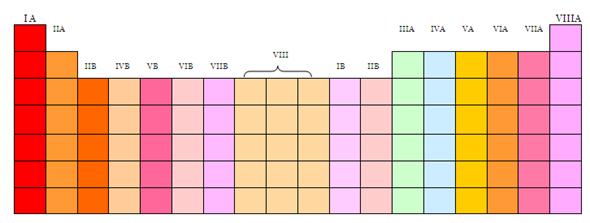
Todos los elementos que pertenecen a un grupo tienen la misma valencia atómica, entendido como el número de electrones en la última capa, y por ello,
tienen propiedades similares entre sí.
La explicación moderna del ordenamiento en la tabla periódica es que los
elementos de un grupo poseen configuraciones
electrónicas similares y la misma valencia atómica, o número de electrones en la última capa. Dado que las propiedades químicas dependen profundamente de las interacciones de los electrones que
están ubicados en los niveles más externos, los elementos de un mismo grupo
tienen propiedades químicas similares.
Por ejemplo, los elementos en el grupo 1 tienen una configuración
electrónica ns1 y una valencia de 1 (un electrón
externo) y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha
son los gases nobles, los cuales tienen lleno su último nivel de energía (regla del octeto)
y, por ello, son excepcionalmente no reactivos y son también llamados gases
inertes.
Numerados de izquierda a derecha utilizando números arábigos, según la
última recomendación de la IUPAC (según la antigua propuesta de la IUPAC) de 1988 y entre
paréntesis según el sistema estadounidense,8 los grupos de la tabla periódica son:
|
|
Bloques
La tabla periódica se puede también dividir en bloques de elementos
según el orbital que estén ocupando los electrones más externos, de acuerdo al
principio de Aufbau. Los bloques o regiones se denominan según la letra que
hace referencia al orbital más externo: s, p, d y f. Podría haber más elementos
que llenarían otros orbitales, pero no se han sintetizado o descubierto; en
este caso se continúa con el orden alfabético para nombrarlos.
ESTRUCTURA Y ORGANIZACIÓN DE LA TABLA PERIÓDICA
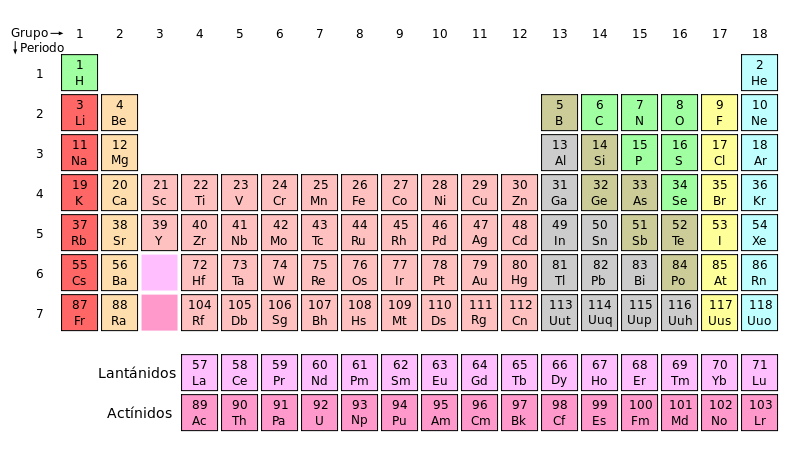
La tabla periódica actual es un sistema donde se clasifican los
elementos conocidos hasta la fecha. Se colocan de izquierda a derecha y de
arriba a abajo en orden creciente de sus números atómicos. Los elementos están
ordenados en siete hileras horizontales llamadas periodos, y en 18 columnas
verticales llamadas grupos o familias.
Hacia abajo y a la izquierda aumenta el radio atómico y el radio iónico.
Hacia arriba y a la derecha aumenta la energía de ionización, la afinidad electrónica y la electronegatividad.
CLASIFICACIÓN DE LOS ELEMENTOS DE LA TABLA PERIÓDICA
Todas las cosas que nos rodean está formadas en su constitución química por una cantidad de elementos básicos conocidos como "elementos químicos", aunque se han podido aislar mas de 100, solo unos pocos tienen abundancia relativa, y son los "ladrillos" con lo que está construido lo que nos rodea, otros aunque escasos son aislados y concentrados por el hombre para usarlos en aplicaciones comunes que podemos tener en nuestras casas y otros son también aislados y concentrados para uso industrial como en la generación de energía atómica. Una parte de los elementos químicos conocidos tienen una vida tan efímera que solo son de interés académico. El científico ruso Dmitri Ivanovich Mendeleev organizó los elementos descubiertos hasta ese momento (1869) en una tabla conocida como "Tabla Periódica de los Elementos" (o tabla de Mendeleev) y de manera genial, dejó vacíos los espacios correspondientes a los que aún no habían sido descubiertos y que se descubrieron en el futuro de manera sorprendentemente acertada. Esto lo convierte en uno de los hombres mas geniales de la historia de las ciencias.
Disposición sistemática de los elementos químicos en función de sus propiedades, iniciada por el químico ruso Dimitri Ivanovich Mendeleev en su libro "Principios de la química" (1869).
Los elementos de una misma columna forman un grupo, los cuales tiene propiedades similares. Estos elementos se dividen en:
- Metales alcalinos.
- Metales Alcalinotérreos.
- Metales Lantánidos.
- Metales Actínidos.
- Metales de Transición.
- Metales del Bloque P.
- Metaloídes.
- No metales.
- Halógenos.
- Gases Nobles.
martes, 1 de julio de 2014
METALES, NO METALES Y SEMIMETALES
La Tabla Periódica permite separar los distintos elementos químicos por sus propiedades físicas y químicas en: metales, no metales y semimetales.
Metales.- Ocupan las zonas izquierda y central de la Tabla Periódica; por tanto, constituyen un grupo mayoritario de los elementos. Presentan propiedades físicas y quimicas variadas. Se caracterizan por:
- Su brillo metálico.
- El color del metal depende de la luz que refleja, por ejemplo, el cobre (Cu) es rojo, el oro (Au) es amarillo.
- Son sólidos a temperatura ambiente, excepto el mercurio que es líquido.
- Son dúctiles (pueden dar forma de hilos).
- Son maleables (pueden convertirse en láminas).
- Son tenaces, pues la mayoría de ellos resisten a la ruptura.
- Son buenos conductores del calor y la electricidad.
- Tienen elevados puntos de fusión.
Algunos metales típicos son hierro, sodio, plata, oro, magnesio, zinc, estaño, plomo, entre otros.
Los metales se combinan con el oxígeno para formar óxidos metálicos. Se pueden mezclar y fundir dos o más metales para la elaboración de las aleaciones.
No metales.- Se ubican en la región superior derecha de la Tabla Periódica.
- A temperatura ambiente suelen ser sólidos, como carbono (C), fósforo (P), azufre (S), selenio (Se), yodo (I); líquidos, como el bromo (Br); gases como hidrógeno (H), nitrógeno (N), oxígeno (O), flúor (F), cloro (Cl).
- Son malos conductores de la electricidad.
- Tienen puntos de fusión bajos y bajas densidades.
- No son brillantes.
- Reaccionan entre sí y con los metales.
Algunos no metales tienen particular importancia por sus aplicaciones. El cloro es un químico que se usa en la purificación del agua y en la elaboración de solventes para lavado en seco.
El nitrógeno se emplea en la fabricación de fertilizantes, preparación de explosivos. Se usa también para inflar los paquetes y envasar los productos al vacío.
El oxigeno se usa para el afinado del acero, también como el combustible de cohetes y misiles. En el campo de la medicina como componente del aire artificial para aquellas personas con insuficiencias respiratorias. El ozono, forma alotrópica del oxígeno, se usa como bactericida, decolorante de aceites, ceras y harinas.
Semimetales.- Se sitúan entre los metales y los no metales. Se comportan unas veces como metales y otras como no metales. Son elementos semimetálicos el boro (B), el silicio (Si), el germanio (Ge), el arsénico (As), el telurio (Te) y el astato (At). Son sólidos a temperatura ambiente, son duros y quebradizos. Se usan como semiconductores porque funcionan como conductores o aislantes.
GASES NOBLES

Los elementos del Grupo VIII de la Tabla Periódica son los gases que tienen las capas completas y no son reactivos químicamente. El helio, neón, argón y criptón se utilizan en la iluminación decorativa por descarga de gas, llamada luz de "neón". El argón se utiliza para llenar las bombillas incandescentes para inhibir la evaporación de los filamentos de tungsteno y aumentar la vida de la bombilla. El xenón se utiliza en tubos de flash para cámaras electrónicas y otros tubos de flash. Las densidades de los gases nobles aumentan con la masa molecular creciente. El helio tiene aproximadamente un séptimo de la densidad del aire y se puede utilizar en globos y embarcaciones más ligeras que el aire. El xenón tiene aproximadamente cinco veces la densidad del aire.
Los gases nobles se utilizan con ventaja en entornos donde se podrían producir corrosión o daños por descargas eléctricas si los ambientes se llenan de aire. Uno de esos usos es en los tubos de luz fluorescente.
Elementos que conforman los gases nobles:
El helio es un elemento perteneciente al grupo de gases nobles y su aspecto es incoloro. El número atómico del helio es el 2 y su símbolo químico es He.
 El neón es un elemento perteneciente al grupo de gases nobles y su aspecto es incoloro. El número atómico del neón es el 10 y su símbolo químico es Ne.
El neón es un elemento perteneciente al grupo de gases nobles y su aspecto es incoloro. El número atómico del neón es el 10 y su símbolo químico es Ne. - Argón
 El argón es un elemento perteneciente al grupo de gases nobles y su aspecto es incoloro. El número atómico del argón es el 18 y su símbolo químico es Ar.
El argón es un elemento perteneciente al grupo de gases nobles y su aspecto es incoloro. El número atómico del argón es el 18 y su símbolo químico es Ar. - Kriptón
El kriptón es un elemento perteneciente al grupo de gases nobles y su aspecto es incoloro. El número atómico del kriptón es el 36 y su símbolo químico es Kr. Descubre las propiedades de este elemento químico y más características de gases nobles.
El radón es un elemento perteneciente al grupo de gases nobles y su aspecto es incoloro. El número atómico del radón es el 86 y su símbolo químico es Rn.
El Ununoctio es un elemento perteneciente al grupo de transactínidos y su aspecto es desconocido. El número atómico del ununoctio es el 118 y su símbolo químico es Uuo
HALÓGENOS
Los elementos halógenos son aquellos que
ocupan el grupo 17 del Sistema Periódico. Los halógenos F, Cl, Br, I y At, son
elementos volátiles, diatómicos y cuyo color se intensifica al aumentar el
número atómico. El flúor es un gas de color amarillo pálido, ligeramente más
pesado que aire, corrosivo y de olor penetrante e irritante. El cloro es un gas
amarillo verdoso de olor penetrante e irritante. El bromo a la temperatura
ambiente es un líquido de color rojo oscuro, tres veces más denso que el agua,
que se volatiliza con facilidad produciendo un vapor rojizo venenoso. El yodo
es un sólido cristalino a temperatura ambiente, de color negro y brillante, que
sublima dando un vapor violeta muy denso, venenoso, con un olor picante como el
del cloro. El Astato es un elemento muy inestable que existe sólo en formas
radiactivas de vida corta, y que aparece en el proceso de desintegración
del 235U. En la Tabla 1 se muestran algunas de las propiedades
físicas y atómicas de los elementos de este grupo.
Todos los átomos poseen una configuración que
difiere de la de gas noble en un electrón, de forma que los elementos tienden a
formar especies negativas, X¯, o a formar enlaces covalentes
simples. La química de estos elementos y sus compuestos cambian con el tamaño
de los mismos.
Como es esperable, los puntos de fusión y
ebullición aumentan al descender en el grupo. Las energías de ionización de los
halógenos presentan valores muy altos que van disminuyendo al aumentar el
número atómico. Las afinidades electrónicas son elevadas como consecuencia de
la tendencia a ganar un electrón y conseguir así la configuración de gas noble.
Los elementos que componen a los halógenos
son:
Flúor
El
flúor es más abundante en la corteza terrestre (0.065%) que el cloro (0.055%),
ocupando el 17º lugar en orden de abundancia en la misma. El flúor se presenta
en la naturaleza en forma combinada como
fluorita (CaF2), criolita (Na3AlF6) y
fluorapatita (Ca5(PO4)3F).
La fluorita, de la que se deriva generalmente
la mayoría de los compuestos de flúor, se obtiene de minas en los Estados
Unidos en grandes depósitos en el norte de Kentucky y el sur de Illinois. La
criolita es un mineral escaso del cual existen pocos yacimientos (sólo en
Groenlandia). Se emplea como material de partida en la industria del aluminio,
pero por lo general la criolita que se emplea es de tipo sintético. La
fluoroapatita es el mineral más abundante de flúor, pero su contenido en flúor
es tan pequeño (3.5% en peso) que se utiliza sólo para obtener su contenido en
fosfato.
El flúor también se presenta como fluoruros
en el agua del mar, ríos, y en formas minerales, en los tallos de ciertos
pastos y en los huesos y dientes de animales.
Cloro
Es el 20º elemento en orden de abundancia de
la corteza terrestre. Además de los grandes depósitos naturales de sal común,
NaCl, existen reservas ingentes de cloro en el océano, con un 3.4% en peso de
sales, de las cuales, el 1.9% son sales de iones cloruros.
Bromo

El bromo es sustancialmente menos abundante
que el cloro o el flúor en la corteza terrestre. Como el cloro, la mayor fuente
natural del bromo está en los océanos (en concentraciones de 65 mg/ml). La
relación de masas del Cl:Br en el agua del mar es de 300:1.
Yodo
El yodo es considerablemente menos abundante
que los halógenos anteriores, tanto en la corteza terrestre como en la
hidrosfera. Se encuentra en forma de yodatos, como los depósitos naturales de
laurita (Ca(IO3)2) y dietzeita (7Ca(IO3)2x8CaCrO4).
También se encuentra como yodo elemental en los yacimientos de nitrato de
Chile. El contenido de yodo en agua es demasiado bajo como para poder explotar
estos yoduros desde el punto de vista industrial.
Astato
Elemento químico con símbolo At y número atómico 85. El ástato es el elemento más pesado del grupo de los halógenos, ocupa el lugar debajo del yodo en el grupo VII de la tabla periódica. El ástato es un elemento muy inestable, que existe sólo en formas radiactivas de vida corta. Se han preparado unos 25 isótopos mediante reacciones nucleares de transmutación artificial. El isótopo con mayor tiempo de vida es el 210At, el cual decae en un tiempo de vida media de sólo 8.3 h. Es improbable que una forma más estable, o de vida más larga, pueda encontrarse en la naturaleza o prepararse en forma artificial. El isótopo más importante es el 211At y se utiliza en marcaje isotópico. El ástato se encuentra en la naturaleza como parte integrante de los minerales de uranio, pero sólo en cantidades traza de isótopos de vida corta, continuamente abastecidos por el lento decaimiento del uranio. La cantidad total de ástato en la corteza terrestre es menor que 28 g (1 onza).
METALES DE TRANSICIÓN
Los elementos de transición son aquellos elementos químicos que están situados en la parte central del sistema periódico, en el bloque d, cuya principal característica es la inclusión en su configuración electrónica del orbital d, parcialmente lleno de electrones. Esta definición se puede ampliar considerando como elementos de transición a aquellos que poseen electrones alojados en el orbital d, esto incluiría a zinc, cadmio, y mercurio. La IUPAC define un metal de transición como "un elemento cuyo átomo tiene una subcapa d incompleta o que puede dar lugar a cationes".
Son metales de transición, ya que tienen una configuración d10. Solo se forman unas pocas especies transitorias de estos elementos que dan lugar a iones con una subcapa dparcialmente completa. Por ejemplo mercurio (I) solo se encuentra como Hg22+, el cual no forma un ion aislado con una subcapa parcialmente llena, por lo que los tres elementos son inconsistentes con la definición anterior. Estos forman iones con estado de oxidación 2+, pero conservan la configuración 4d10. El elemento 112 podría también ser excluido aunque sus propiedades de oxidación no son observadas debido a su naturaleza radioactiva. Esta definición corresponde a los grupos 3 a 11 de la tabla periódica.
Según la definición más amplia los metales de transición son los cuarenta elementos químicos, del 21 al 30, del 39 al 48, del 71 al 80 y del 103 al 112. El nombre de "transición" proviene de una característica que presentan estos elementos de poder ser estables por si mismos sin necesidad de una reacción con otro elemento. Cuando a su última capa de valencia le faltan electrones para estar completa, los extrae de capas internas. Con eso es estable, pero le faltarían electrones en la capa donde los extrajo, así que los completa con otros electrones propios de otra capa. Y así sucesivamente; este fenómeno se le llama "Transición electrónica". Esto también tiene que ver con que estos elementos sean tan estables y difíciles de hacer reaccionar con otros. La definición más amplia es la que tradicionalmente se ha utilizado. Sin embargo muchas propiedades interesantes de los elementos de transición como grupo son el resultado de su subcapa d parcialmente completa. Las tendencias periódicas del bloque d son menos predominantes que en el resto de la tabla periódica. A través de ésta la valencia no cambia porque los electrones adicionados al átomo van a capas internas.


Los elementos que conforman los metales de transición son:
- Escandio
El escandio es un elemento perteneciente al grupo de metales de transición y su aspecto es blanco plateado. El número atómico del escandio es el 21 y su símbolo químico es Sc.
- Titanio
El titanio es un elemento perteneciente al grupo de metales de transición y su aspecto es plateado. El número atómico del titanio es el 22 y su símbolo químico es Ti.
- Vanadio
El vanadio es un elemento perteneciente al grupo de metales de transición y su aspecto es metálico gris plateado. El número atómico del vanadio es el 23 y su símbolo químico es V.
- Cromo
El cromo es un elemento perteneciente al grupo de metales de transición y su aspecto es plateado metálico. El número atómico del cromo es el 24 y su símbolo químico es Cr.
- Manganeso
El manganeso es un elemento perteneciente al grupo de metales de transición y su aspecto es plateado metálico. El número atómico del manganeso es el 25 y su símbolo químico es Mn.
- Hierro
El hierro es un elemento perteneciente al grupo de metales de transición y su aspecto es metálico brillante con un tono grisáceo. El número atómico del hierro es el 26 y su símbolo químico es Fe.
- Cobalto
El cobalto es un elemento perteneciente al grupo de metales de transición y su aspecto es metálico con tono gris. El número atómico del cobalto es el 27 y su símbolo químico es Co.
- Niquel
El níquel es un elemento perteneciente al grupo de metales de transición y su aspecto es lustroso metálico. El número atómico del níquel es el 28 y su símbolo químico es Ni.
- Cobre
El cobre es un elemento perteneciente al grupo de metales de transición y su aspecto es metálico, rojizo. El número atómico del cobre es el 29 y su símbolo químico es Cu.
- Zinc
El zinc es un elemento perteneciente al grupo de metales de transición y su aspecto es azul pálido grisáceo. El número atómico del zinc es el 30 y su símbolo químico es Zn
- Itrio
El itrio es un elemento perteneciente al grupo de metales de transición y su aspecto es blanco plateado. El número atómico del itrio es el 39 y su símbolo químico es Y.
- Zirconio
El zirconio es un elemento perteneciente al grupo de metales de transición y su aspecto es blanco grisáceo. El número atómico del zirconio es el 40 y su símbolo químico es Zr
- Niobio
El niobio es un elemento perteneciente al grupo de metales de transición y su aspecto es gris metálico. El número atómico del niobio es el 41 y su símbolo químico es Nb.
- Molibdeno
El molibdeno es un elemento perteneciente al grupo de metales de transición y su aspecto es gris metálico. El número atómico del molibdeno es el 42 y su símbolo químico es Mo.
- Tecnecio
El tecnecio es un elemento perteneciente al grupo de metales de transición y su aspecto es metálico plateado. El número atómico del tecnecio es el 43 y su símbolo químico es Tc.
- Rutenio
El rutenio es un elemento perteneciente al grupo de metales de transición y su aspecto es blanco grisáceo. El número atómico del rutenio es el 44 y su símbolo químico es Ru.
- Rodio
El rodio es un elemento perteneciente al grupo de metales de transición y su aspecto es blanco plateado metálico. El número atómico del rodio es el 45 y su símbolo químico es Rh.
- Paladio
El paladio es un elemento perteneciente al grupo de metales de transición y su aspecto es blanco plateado metálico. El número atómico del paladio es el 46 y su símbolo químico es Pd.
- Plata
La plata es un elemento perteneciente al grupo de metales de transición y su aspecto es plateado. El número atómico del plata es el 47 y su símbolo químico es Ag.
- Cadmio
El cadmio es un elemento perteneciente al grupo de metales de transición y su aspecto es plateado gris metálico. El número atómico del cadmio es el 48 y su símbolo químico es Cd.
- Hafnio
El hafnio es un elemento perteneciente al grupo de metales de transición y su aspecto es gris acero. El número atómico del hafnio es el 72 y su símbolo químico es Hf.
- Tantalio
El tantalio es un elemento perteneciente al grupo de metales de transición y su aspecto es azul grisáceo. El número atómico del tantalio es el 73 y su símbolo químico es Ta.
- Wolframio
El wolframio (tungsteno) es un elemento perteneciente al grupo de metales de transición y su aspecto es blanco grisáceo, brilloso. El número atómico del wolframio (tungsteno) es el 74 y su símbolo químico es W.
- Renio
El renio es un elemento perteneciente al grupo de metales de transición y su aspecto es blanco grisáceo. El número atómico del renio es el 75 y su símbolo químico es Re.
- Osmio
El osmio es un elemento perteneciente al grupo de metales de transición y su aspecto es azul grisáceo. El número atómico del osmio es el 76 y su símbolo químico es Os.
- Iridio
El iridio es un elemento perteneciente al grupo de metales de transición y su aspecto es blanco plateado. El número atómico del iridio es el 77 y su símbolo químico es Ir.
- Platino
El platino es un elemento perteneciente al grupo de metales de transición y su aspecto es blanco grisáceo. El número atómico del platino es el 78 y su símbolo químico es Pt.
- Oro
El oro es un elemento perteneciente al grupo de metales de transición y su aspecto es amarillo metálico. El número atómico del oro es el 79 y su símbolo químico es Au
- Mercurio
El mercurio es un elemento perteneciente al grupo de metales de transición y su aspecto es blanco plateado. El número atómico del mercurio es el 80 y su símbolo químico es Hg.
- Laurencio
El laurencio es un elemento perteneciente al grupo de metales de transición y su aspecto es desconocido, probablemente metálico plateado blanco o gris. El número atómico del laurencio es el 103 y su símbolo químico es Lr.
- Rutherfordio
El rutherfordio es un elemento perteneciente al grupo de metales de transición y su aspecto es desconocido, probablemente metálico plateado blanco o gris. El número atómico del rutherfordio es el 104 y su símbolo químico es Rf.
- Dubnio
El dubnio es un elemento perteneciente al grupo de metales de transición y su aspecto es desconocido, probablemente metálico plateado blanco o gris. El número atómico del dubnio es el 105 y su símbolo químico es Db.
- Seaborgio
El seaborgio es un elemento perteneciente al grupo de metales de transición y su aspecto es desconocido, probablemente metálico plateado blanco o gris. El número atómico del seaborgio es el 106 y su símbolo químico es Sg.
- Bohrio
El bohrio es un elemento perteneciente al grupo de metales de transición y su aspecto es desconocido, probablemente metálico plateado blanco o gris. El número atómico del bohrio es el 107 y su símbolo químico es Bh.
- Hassio
El hassio es un elemento perteneciente al grupo de metales de transición y su aspecto es desconocido, probablemente metálico plateado blanco o gris. El número atómico del hassio es el 108 y su símbolo químico es Hs.
- Meitnerio
El meitnerio es un elemento perteneciente al grupo de metales de transición y su aspecto es desconocido, probablemente metálico plateado blanco o gris. El número atómico del meitnerio es el 109 y su símbolo químico es Mt.
- Darmstadtio
El darmstadtio es un elemento perteneciente al grupo de metales de transición y su aspecto es desconocido, probablemente metálico plateado blanco o gris. El número atómico del darmstadtio es el 110 y su símbolo químico es Ds
- Roentgenio
El roentgenio es un elemento perteneciente al grupo de metales de transición y su aspecto es desconocido, probablemente metálico plateado blanco o gris. El número atómico del roentgenio es el 111 y su símbolo químico es Rg.
- Copernicio
METALES TÉRREOS: ELEMENTOS
Los elementos que pertenecen al grupo III, llamados TÉRREOS, son el boro, aluminio, galio, indio y talio. Tienen 3 electrones en el último nivel, siendo su configuración electrónica externa ns2np1.
Estos metales forman también compuestos moleculares lo que muestra la variación gradual dentro de la tabla desde el carácter metálico al no metálico.
No se hallan en estado libre.
BORO

•Elemento químico, B, número atómico 5, peso
atómico 10.811. Tiene tres elementos de valencia y se comporta como no metal.
Se clasifica como metaloide y es el único elemento no metálico con menos de
cuatro electrones en la capa externa.
La forma cristalina es un sólido quebradizo,
muy duro. Es de color negro azabache a gris plateado con brillo metálico. Una
forma de boro cristalino es rojo brillante. La forma amorfa es menos densa que
la cristalina y es un polvo que va del café castaño al negro. En los compuestos
naturales, el boro se encuentra como una mezcla de dos isótopos estables, con
pesos atómicos de 10 y 11.
Muchas propiedades del boro no están lo
suficientemente establecidas en forma experimental por la pureza discutible de
algunas fuentes de boro, las variaciones en los métodos y las temperaturas de
preparación.
El boro constituye el 0.001% en la corteza
terrestre. Nunca se ha encontrado libre. Está también presente en el agua de
mar en unas cuantas partes por millón (ppm). Existe en pequeñas cantidades en
la mayoría de los suelos y es un constituyente esencial de varios silicatos
tales como la turmalina y la datolita. La presencia de boro en cantidades muy
pequeñas parece ser necesaria en casi todas las plantas, pero en grandes
concentraciones es muy tóxico para la vegetación. En la naturaleza hay sólo un
número limitado de localidades con concentraciones altas de boro o grandes
depósitos de minerales; los más importantes parecen ser de origen volcánico.
ALUMINIO

Elemento químico metálico, de símbolo Al,
número atómico 13, peso atómico 26.9815, que pertenece al grupo IIIA del
sistema periódico. El aluminio puro es blando y tiene poca resistencia
mecánica, pero puede formar aleaciones con otros elementos para aumentar su resistencia
y adquirir varias propiedades útiles. Las aleaciones de aluminio son ligeras,
fuertes, y de fácil formación para muchos procesos de metalistería; son fáciles
de ensamblar, fundir o maquinar y aceptan gran variedad de acabados. Por sus
propiedades físicas, químicas y metalúrgicas, el aluminio se ha convertido en
el metal no ferroso de mayor uso.
El aluminio es el elemento metálico más
abundante en la Tierra y en la Luna, pero nunca se encuentra en forma libre en
la naturaleza. Se halla ampliamente distribuido en las plantas y en casi todas
las rocas, sobre todo en las ígneas, que contienen aluminio en forma de
minerales de alúmino silicato. Cuando estos minerales se disuelven, según las
condiciones químicas, es pos ible precipitar el aluminio en forma de arcillas
minerales, hidróxidos de aluminio o ambos. En esas condiciones se forman las
bauxitas que sirven de materia prima fundamental en la producción de aluminio.
Es anfótero y puede reaccionar con ácidos minerales para formar sales solubles
con desprendimiento de hidrógeno.El aluminio fundido puede tener reacciones
explosivas con agua. El metal fundido no debe entrar en contacto con
herramientas ni con contenedores húmedos. A temperaturas altas, reduce muchos
compuestos que contienen oxígeno, sobre todo los óxidos metálicos. Estas
reacciones se aprovechan en la manufactura de ciertos metales y aleaciones.
GALIO
Elemento químico, símbolo Ga, número atómico
31 y peso atómico 69.72. lo descubrió Lecoq de Boisbaudran en Francia en 1875.
Tiene un gran intervalo de temperatura en el estado líquido, y se ha
recomendado su uso en termómetros de alta temperatura y manómetros. En aleación
con plata y estañó, el galio suple en forma adecuada la amalgama en curaciones
dentales; también sirve para soldar materiales no metálicos, incluyendo gemas o
metales. El arseniuro de galio puede utilizarse en sistemas para transformar
movimiento mecánico en impulsos eléctricos. Los artículos sintéticos
superconductores pueden prepararse por la fabricación de matrices porosas de
vanadio o tántalo impregnados con hidruro de galio. El galio ha dado excelentes
resultados como semiconductor para uso en rectificadores, transistores,
fotoconductores, fuentes de luz, diodos láser o máser y aparatos de
refrigeración.
El galio sólido parece gris azulado cuando se
expone a la atmósfera. El galio líquido es blanco plateado, con una superficie
reflejante brillante. Su punto de congelación es más bajo que el de cualquier
metal con excepción del mercurio (-39ºC o -38ºF) y el cesio (28.5ºC u 83.3ºF).
El galio es semejante químicamente al
aluminio. Es anfótero, pero poco más ácido que el aluminio. La valencia normal
del galio es 3+ y forma hidróxidos, óxidos y sales. El galio funde al contacto
con el aire cuando se calienta a 500ºC (930ºF). Reacciona vigorosamente con
agua hirviendo, pero ligeramente con agua a temp eratura ambiente. Las sales de
galio son incoloras; se preparan de manera directa a partir del metal, dado que
la purificación de éste es más simple que la de sus sales.
El
galio forma aleaciones eutécticas de bajo punto de fusión con varios metales, y
compuestos intermetálicos con muchos otros. Todo el aluminio contiene
cantidades pequeñas de galio, como impureza inofensiva, pero la penetración
intergranular de grandes cantidades a 30ºC causa fallas catastróficas.
INDIO

Elemento
químico de símbolo In, de número atómico 49, el indio tiene un número atómico
relativo de 114.82. Se encuentra aproximadamente en un 0.000001% en la corteza
terrestre y normalmente en concentraciones de 0.1% o menores. Se halla
distribuido ampliamente en muchas minas y minerales y se recobra en gran parte
de los co nductos de polvo y residuos de las operaciones de procesamiento de
zinc.
El
indio se utiliza para soldar alambre de plomo a transistores de germanio y como
componente de los semiconductores intermetálicos empleados en los transistores
de germanio. El arseniuro de indio, antimoniuro y fosfuro son semiconductores
con propiedades especiales. Otros usos del indio se encuentran en la producción
de recubrimientos para reducir la corrosión y el desgaste, en las aleaciones
para sellado de vidrio y en las aleaciones dentales.
TALIO
Elemento
químico de símbolo Tl, número atómico 81 y peso atómico relativo 204.37. La
notación de los electrones de valencia correspondiente al estado basal es
6s26p1, que explica un máximo de oxidación de III en sus compuestos. Se conocen
también compuestos con estado de oxidación de I y con estado de oxidación
evidente II.
El talio se encuentra en la
corteza terrestre en proporción de 0.00006%, principalmente como compuesto
minoritario en minerales de hierro, cobre, sulfuros y seleniuros. Los minerales
de talio se consideran raros. Tiene un
empleo importante en los componentes electrónicos; por ejemplo, los cristales
de yoduro de sodio, activados por talio y usados en tubos fotomultiplicadores.
También se utiliza en aleaciones de bajo punto de fusión, lentes ópticas y
sellos de vidrio para almacenar componentes electrónicos. Los compuestos de
talio son muy tóxicos para los seres humanos y otras formas de vida.
Suscribirse a:
Entradas (Atom)