Los seres humanos
siempre hemos estado tentados a encontrar una explicación a la complejidad de
la materia que nos rodea. Al principio se pensaba que los elementos de toda
materia se resumían al agua, tierra, fuego y aire. Sin embargo al cabo del
tiempo y gracias a la mejora de las técnicas de experimentación física y
química, nos dimos cuenta de que la materia es en realidad más compleja de lo
que parece. Los químicos del siglo XIX encontraron entonces la necesidad de ordenar
los nuevos elementos descubiertos. La primera manera, la más natural, fue la
de clasificarlos por masas
atómicas, pero esta
clasificación no reflejaba las diferencias y similitudes entre los elementos.
Muchas más clasificaciones fueron adoptadas antes de llegar a la tabla periódica que es utilizada en nuestros
días.
PROYECTO DE QUÍMICA: TABLA PERIÓDICA
viernes, 4 de julio de 2014
CRONOLOGÍA DE LA CLASIFICACIÓN DE LOS ELEMENTOS QUÍMICOS
- Döbereiner
- Chancourtois y Newlands
- Meyer
- Mendeléiev
Esta tabla fue
diseñada de manera que hiciera aparecer la periodicidad de los elementos. De
esta manera los elementos son clasificados verticalmente. Las agrupaciones
horizontales se suceden representando los elementos de la misma “familia”.
Para poder aplicar
la ley que él creía cierta, tuvo que dejar ciertos huecos vacíos. Él estaba
convencido de que un día esos lugares vacíos que correspondían a las masas
atómicas 45, 68, 70 y 180, no lo estarían más, y los descubrimientos futuros
confirmaron esta convinción. El consiguió además prever las propiedades químicas
de tres de los elementos que faltaban a partir de las propiedades de los cuatro
elementos vecinos. Entre 1875 y 1886, estos tres elementos: galio, escandio y
germanio, fueron descubiertos y ellos poseían las propiedades predecidas.
Sin embargo aunque
la la clasificación de Mendeleïev marca un claro progreso, contiene ciertas
anomalías debidas a errores de determinación de masa atómica de la época.
Tabla periódica moderna
Un grupo de la tabla periódica es una columna vertical de la tabla. Hay 18 grupos en la tabla estándar. El hecho de que la mayoría de estos grupops correspondan directamente a una serie químmica no es fruto del azar. La tabla ha sido inventada para organizar las series químicas conocidas dentro de un esquema coherente. La distribución de los elementos en la tabla periódica proviene del hecho de que los elementos de un mismo grupo poseen la misma configuración electrónica en su capa más externa. Como el comportamiento químico está principalmente dictado por las interacciones de estos electrones de la última capa, de aquí el hecho de que los elementos de un mismo grupo tengan similares propiedades físicas y químicas.
VENTAJAS DE LA CLASIFICACIÓN DE LA TABLA PERIÓDICA
1.-Clasifica
los elementos en orden creciente a su peso atómico
2.-
Análisis de las propiedades periódicas de los elementos, es decir, la
comparación de sus propiedades según su ubicación en la tabla periódica.
3.-Establece familias y sub familias que tienen
propiedades semejantes, ejemplo la familia de los halógenos, alógenos
nitrogenoides del alcalino etc.
4.-Permite
conocer el número de niveles cuánticos que lleva un átomo.
5.-Permite
conocer el número de electrones que lleva un átomo en su último nivel cuántico.
6.-Permite
conocer el valor de electronegatividad de un elemento y predecir su reacción
7.-Permite
conocer la valencia negativa y positiva que tiene un elemento.
8.-Distribiye
adecuadamente en la tabla a los elementos; metálicos; no metalicos,gases
nobles; tierras raras
9.-Permite
desarrollar fácilmente la estructura de un átomo ya que de acuerdo al grupo y al
periodo, se deduce el número de electrones protones y neutrones.
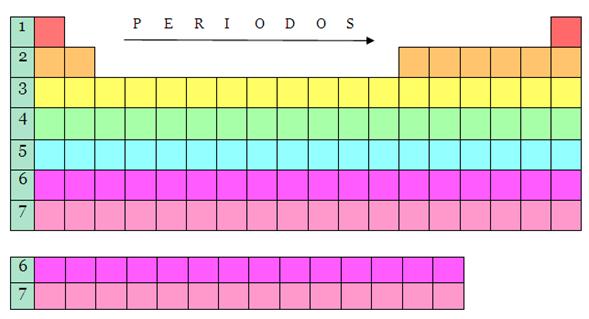
PERIODOS
Las filas horizontales de la tabla periódica son llamadas períodos. El
número de niveles energéticos de un átomo determina el periodo al que pertenece.
Cada nivel está dividido en distintos subniveles, que conforme aumenta su número atómico se van llenando en este orden:
Siguiendo esa norma, cada elemento se coloca según su configuración electrónica y da forma a la tabla periódica. Los electrones situados en niveles más externos determinan en gran medida
las propiedades químicas, por lo que éstas tienden a ser similares dentro de un mismo grupo, sin
embargo la masa atómica varía considerablemente incluso entre elementos adyacentes. Al
contrario, dos elementos adyacentes de mismo periodo tienen una masa similar,
pero propiedades químicas diferentes.
La tabla periódica consta de 7 períodos:
·
Periodo 1._ El primer período solo llena el
primer nivel de energía (1s) y contiene menos elementos que cualquier otra fila
de la tabla, sólo dos: el hidrógeno y el helio. Estos elementos se agrupan en
la primera fila en virtud de propiedades que comparten entre sí.
·
Periodo 2._ Se comienza una hilera nueva
cuando el comportamiento químico vuelve a repetirse, lo que significa que los
elementos de comportamiento similar se encuentran en las mismas columnas
verticales. El segundo período contiene más elementos que la hilera anterior,
con ocho elementos: Litio, Berilio, Boro, Carbono, Nitrógeno, Oxígeno, Flúor y
Neón.
·
Periodo 3._ El tercer periodo es aquello que
se haya compuesto por los siguientes elementos: Na, Mg, Al, Si, P, S, Cl, Ar.
·
Periodo 4._ El cuarto periodo se haya estructurados por los siguientes
elementos: K, Ca, Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Ga, Ge, As, Se, Br,
Kr.
·
Periodo 5._ El quinto periodo se haya
compuesto por estos elementos: Rb, Sr, Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd,
In, Sn, Sb, Te, I, Xe.
·
Periodo 6._ este periodo cuenta con los
siguientes elementos: Cs , Ba, Hf, Ta, W,
Re, Os, Ir, Pt, Au, Hg, Tl, Pb, Bi, Po, At, Rn,
La, Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, L
Periodo 7._ Son: Fr, Ra, Rf, Db, Sg,
Bh, Hs, Mt, Ds, Rg, Fl
GRUPOS
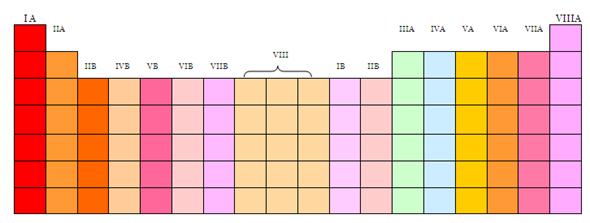
Todos los elementos que pertenecen a un grupo tienen la misma valencia atómica, entendido como el número de electrones en la última capa, y por ello,
tienen propiedades similares entre sí.
La explicación moderna del ordenamiento en la tabla periódica es que los
elementos de un grupo poseen configuraciones
electrónicas similares y la misma valencia atómica, o número de electrones en la última capa. Dado que las propiedades químicas dependen profundamente de las interacciones de los electrones que
están ubicados en los niveles más externos, los elementos de un mismo grupo
tienen propiedades químicas similares.
Por ejemplo, los elementos en el grupo 1 tienen una configuración
electrónica ns1 y una valencia de 1 (un electrón
externo) y todos tienden a perder ese electrón al enlazarse como iones positivos de +1. Los elementos en el último grupo de la derecha
son los gases nobles, los cuales tienen lleno su último nivel de energía (regla del octeto)
y, por ello, son excepcionalmente no reactivos y son también llamados gases
inertes.
Numerados de izquierda a derecha utilizando números arábigos, según la
última recomendación de la IUPAC (según la antigua propuesta de la IUPAC) de 1988 y entre
paréntesis según el sistema estadounidense,8 los grupos de la tabla periódica son:
|
|
Bloques
La tabla periódica se puede también dividir en bloques de elementos
según el orbital que estén ocupando los electrones más externos, de acuerdo al
principio de Aufbau. Los bloques o regiones se denominan según la letra que
hace referencia al orbital más externo: s, p, d y f. Podría haber más elementos
que llenarían otros orbitales, pero no se han sintetizado o descubierto; en
este caso se continúa con el orden alfabético para nombrarlos.
Suscribirse a:
Comentarios (Atom)