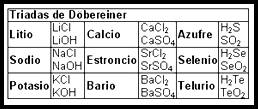
Tabla periódica de Mendeleiev:
La tabla periódica de los elementos fue
propuesta por Dimitri Mendeleiev y Julius Lothar Meyer quienes, trabajando por separado, prepararon una
ordenación de todos los 64 elementos conocidos, basándose en la variación de
las propiedades químicas (Mendeleiev) y físicas (Meyer) con la variación de sus
masas atómicas. A diferencia de lo que había supuesto Newlands, en la Tabla periódica de
Mendeleiev los periodos
(filas diagonales y oblicuas) no tenían siempre la misma longitud, pero a lo
largo de los mismos había una variación gradual de las propiedades, de tal
forma que los elementos de un mismo grupo o familia se correspondían en los
diferentes periodos. Esta tabla fue publicada en 1869, sobre la base de que las
propiedades de los elementos son función periódica de sus pesos atómicos.
La noción de
número atómico y la mecánica cuántica
La tabla periódica de Mendeléiev presentaba
ciertas irregularidades y problemas. En las décadas posteriores tuvo que
integrar los descubrimientos de los gases nobles, las "tierras raras"
y los elementos radioactivos. Otro problema adicional eran las irregularidades
que existían para compaginar el criterio de ordenación por peso atómico
creciente y la agrupación por familias con propiedades químicas comunes.
Ejemplos de esta dificultad se encuentran en las parejas telurio-yodo,
argon-potasio y cobalto-niquel, en las que se hace necesario alterar el
criterio de pesos atómicos crecientes en favor de la agrupación en familias con
propiedades químicas semejantes. Durante algún tiempo, esta cuestión no
pudo resolverse satisfactoriamente hasta que Henry Moseley (1867-1919)
realizó un estudio sobre los espectros de rayos X en 1913. Moseley comprobó que
al representar la raiz cuadrada de la frecuencia de la radiación en función del
número de orden en el sistema periódico se obtenía una recta, lo cual permitía
pensar que este orden no era casual sino reflejo de alguna propiedad de la
estructura atómica. Hoy sabemos que esa propiedad es el número atómico (Z) o número de
cargas positivas del núcleo. La explicación que aceptamos actualmente de la
"ley periódica" descubierta por los químicos de mediados del siglo
pasado surgió tras los desarrollos teóricos producidos en el primer tercio del
siglo XX. En el primer tercio del siglo XX se construyó la mecánica cuántica. Gracias a estas
investigaciones y a los desarrollos posteriores, hoy se acepta que la
ordenación de los elementos en el sistema periódico está relacionada con la
estructura electrónica de los átomos de los diversos elementos, a partir de la
cual se pueden predecir sus diferentes propiedades químicas.
Tabla periódica de Mendeléyev
Basándose en la hipótesis de que las
propiedades de los elementos son función periódica de sus
pesos atómicos, Dmitri
Mendeléyev publicó en el año 1869 una tabla periódica en la que situó todos los elementos conocidos en aquella época,
ordenando los elementos de forma tal que los elementos pertenecientes a una
misma familia aparecen en la misma línea horizontal.
Primera Tabla
Periódica de Mendeléyev (1869)
|
|||||
I
|
II
|
III
|
IV
|
V
|
VI
|
.
|
.
|
.
|
Ti = 50
|
Zr = 90
|
? = 180
|
.
|
.
|
.
|
V = 51
|
Nb = 94
|
Ta = 182
|
.
|
.
|
.
|
Cr = 52
|
Mo = 96
|
W = 186
|
.
|
.
|
.
|
Mn = 55
|
Rh = 104,4
|
Pt = 197,4
|
.
|
.
|
.
|
Fe = 56
|
Ru = 104,4
|
Ir = 198
|
.
|
.
|
.
|
Ni = Co = 59
|
Pd = 106,6
|
Os = 199
|
H = 1
|
.
|
.
|
Cu = 63,4
|
Ag = 108
|
Hg = 200
|
.
|
Be = 9,4
|
Mg = 24
|
Zn = 65,4
|
Cd = 112
|
.
|
.
|
B = 11
|
Al = 27,4
|
? = 68
|
Ur = 116
|
Au = 197?
|
.
|
C = 12
|
Si = 28
|
? = 70
|
Sn = 118
|
.
|
.
|
N = 14
|
P = 31
|
As = 75
|
Sb = 122
|
Bi = 210
|
.
|
O = 16
|
S = 32
|
Se = 79,4
|
Te = 128?
|
.
|
.
|
F = 19
|
Cl = 35,5
|
Br = 80
|
J = 127
|
.
|
Li = 7
|
Na = 23
|
K = 39
|
Rb = 85,4
|
Cs = 133
|
Tl = 204
|
.
|
.
|
Ca = 40
|
Sr = 87,6
|
Ba = 137
|
Pb = 207
|
.
|
.
|
? = 45
|
Ce = 92
|
.
|
.
|
.
|
.
|
?Er = 56
|
La = 94
|
.
|
.
|
.
|
.
|
?Yt = 60
|
Di = 95
|
.
|
.
|
.
|
.
|
?In = 75,6
|
Th = 118?
|
.
|
.
|
El descubrimiento del helio causó a Mendeléyev una gran contrariedad, ya
que este nuevo elemento no tenía un lugar adecuado para colocarse en la Tabla,
pero en el fondo fue una brillante confirmación de la ley periódica ya que el
helio, junto con los demás gases nobles descubiertos más tarde, constituyeron
el grupo 0.
Éstas eran anomalías en la tabla, así que, debido a la universalidad de
la ley, él predijo la existencia de los elementos con las características
indicadas por el espacio que ocupan en la tabla. Empleó la palabra sánscrita eka, dvi y tri;
que significan respectivamente uno, dos y tres.
En 1875 el francés Lecoq de Boisbaudran encontró al eka-Aluminio y lo
llamó Galio; en 1879 eka-Boro fue
descubierto por el sueco Nilson que lo llamó Escandio; finalmente en 1886 el alemán Winkler encontró
al Germanio.
Pero hay más. A medida que extraemos las implicaciones del descubrimiento
de Mendeléyev, empezamos a desarrollar las implicaciones astrofísicas, que están implícitas en la universalidad de la
ley, es decir, el proceso de generación de elementos. No buscamos una evolución darwiniana, sino una evolución vernadskiana.